アンチセンス核酸 vs. siRNA
核酸医薬は低分子医薬や抗体医薬に続く新たな創薬手法として近年注目を集めています。
核酸医薬にはいくつかの作用様式がありますが、主な作用様式として、疾病の原因となる遺伝子のmRNAを標的として作用し、タンパク質への翻訳を抑制することで薬効を発揮する形が挙げられます。従来の作用機序と異なることから難病の治療薬開発につながると期待されています。
この様式で作用する核酸医薬にはアンチセンス核酸(アンチセンスオリゴヌクレオチド)とsiRNAが多く使用されています。それでは、アンチセンス核酸はsiRNAとどう違うのでしょうか。
作用機構の違いについて
アンチセンス核酸とsiRNAは両方ともmRNAに作用しますが、下に説明する通り、作用する機構は微妙に異なります。
① RNA分解型アンチセンス核酸
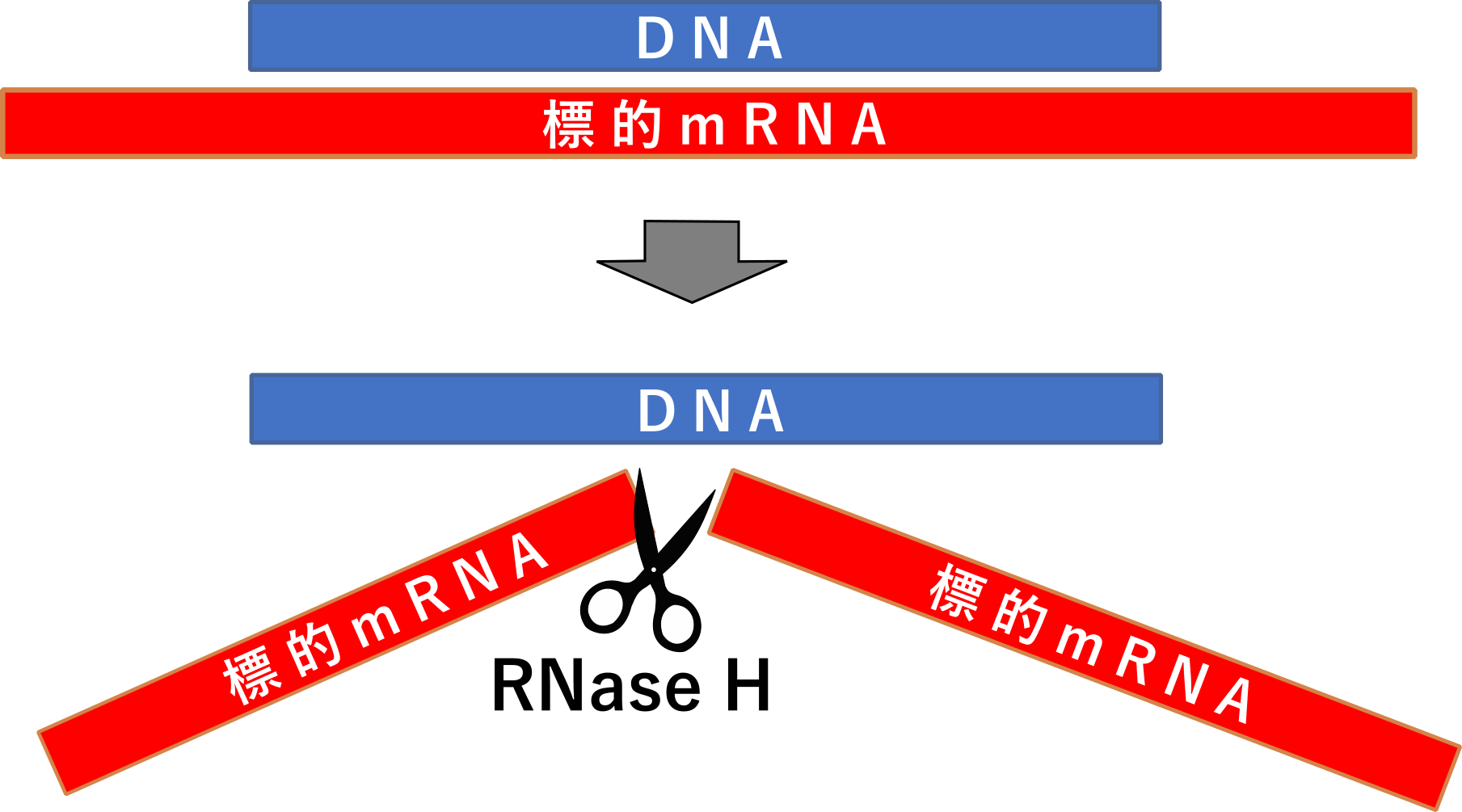
アンチセンス核酸はDNAにハイブリダイゼーションしたRNAのホスホジエステル結合を特異的に加水分解するRNase H活性を利用し、ターゲットRNA(mRNA, miRNA etc)とハイブリッドを形成するDNAを加えることでターゲットを特異的に切断するものです。
この作用機構より、使用するオリゴヌクレオチドにはRNase Hの認識を誘導するためDNAを主に使用し、核酸分解酵素への耐性を付与するためホスホロチオエート化(S化)を施します。
② スプライシング制御型アンチセンス核酸
アンチセンス核酸にはスプライス部位に強く結合し、スプライシングに関わるタンパク質の結合を阻害することで作用するものもあり、スプライシング調節薬として医薬品に使用されています。スプライシングを誘導するためにスプライシング制御因子のアクセス部位(Exon Splicing Enhancer (ESE) 部位)にアンチセンスオリゴをハイブリッド形成させ、制御因子のアクセスを阻害してスプライシングを促進(スプライススイッチング)させます。
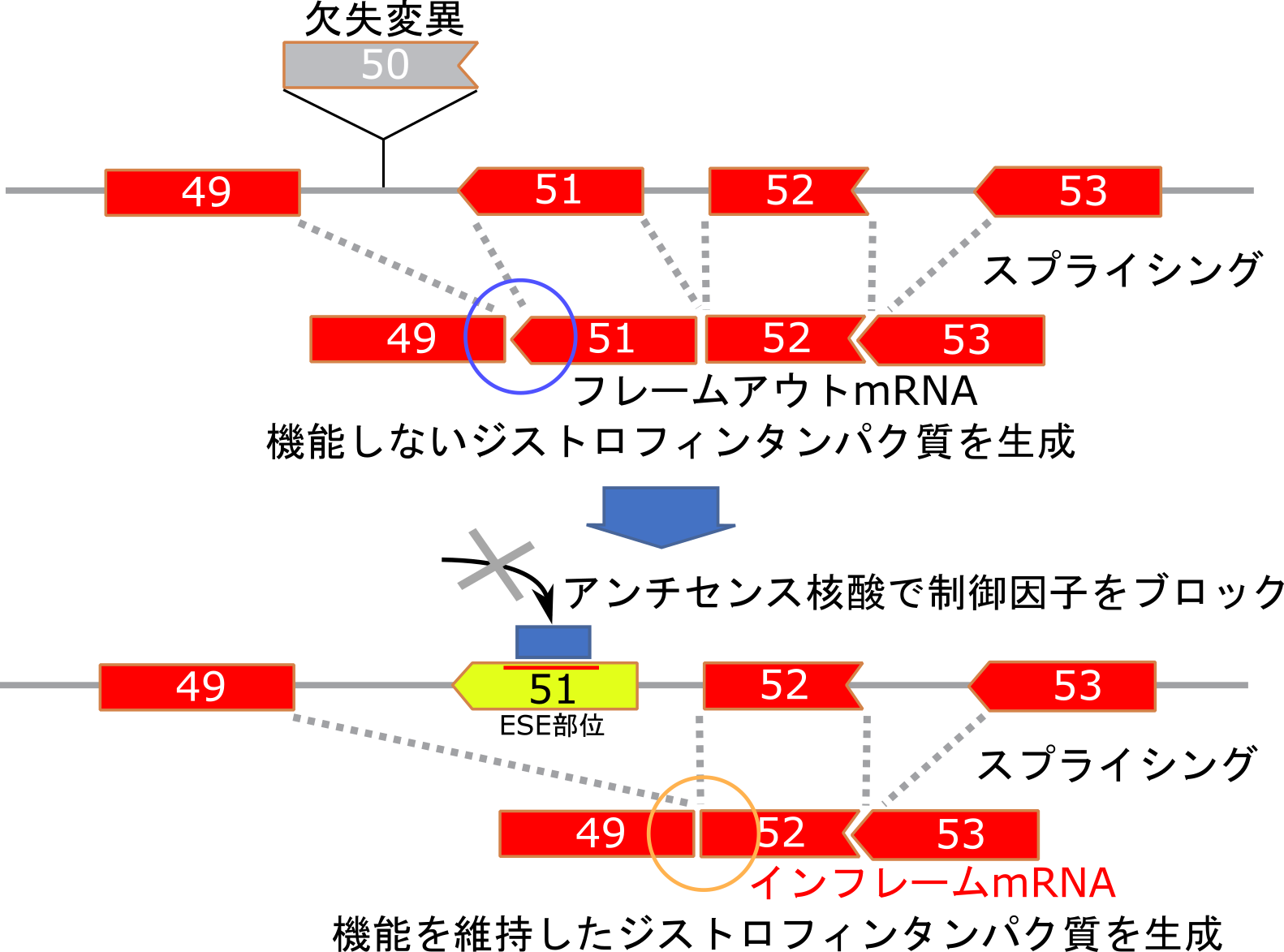
このタイプのアンチセンス核酸はmiRNAとハイブリッドを形成してmiRNAとmiRNA結合分子の結合を阻害することも可能です。
アンチセンス核酸としてmRNAにハイブリッドする1本鎖核酸は、RNA分解型、スプライシング制御型を問わず投与後核内まで到達するため、核およびサイトプラズムのRNA、mRNAやmRNA前駆体、miRNAなど広範なRNAクラスに作用します。
・アンチセンス核酸の特徴
- アンチセンス核酸はDNA/RNAハイブリッドを形成してmRNAに作用
- RNase Hによる分解とスプライシング調節の2つの作用様式がある
- 分子量が小さく核内まで到達するためmRNA, pre-miRNA, miRNAと多様な分子種をノックダウン
③ siRNA
これに対し、siRNAはRNAi反応を利用し、2本鎖RNAを加えて細胞内でRISCを形成させ、RISCによってターゲットを特異的に切断します。
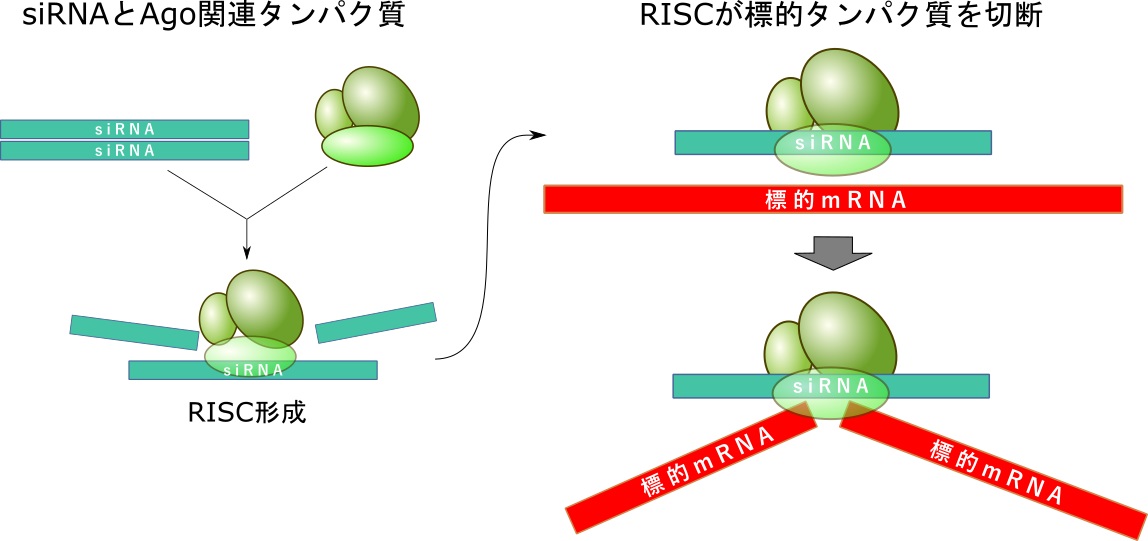
従ってRNAオリゴを2本鎖にして使用しますが、RNAは核酸分解酵素への耐性が低いため、耐性を上げるためにしばしば修飾核酸を導入し、リポソームに封入して耐性を付与します。
また、細胞内への導入のためにリポソームへの封入のほか、GalNAcなどのリガンド付加なども行われます。
siRNAは2本鎖で膜の透過度が低く核まで到達しないため、ターゲットとなる分子はmRNAとなります。
・siRNAの特徴
- siRNAは2本鎖RNAが細胞内でRISCを形成、RISCがターゲット遺伝子を切断、分解に至る
- 2本鎖で分子量が大きいので細胞質で作用、主にmRNAをノックダウン
- ヌクレアーゼ耐性が低いため、耐性向上のため修飾核酸やリガンドによる改良が近年著しい
ニッポンジーンマテリアルではアンチセンス核酸に使用される修飾核酸を用いたオリゴヌクレオチドやsiRNAの合成を行っています。核酸研究・配列スクリーニング・条件検討にご使用いただけます。
核酸医薬品研究・開発用オリゴヌクレオチド合成サービス
ニッポンジーンのsiRNA合成サービスでもsiRNA合成を承っています。
FAQ
アンチセンス核酸に使用されるホスホロチオエート化とはどのような修飾ですか?
核酸のホスホジエステル(PO)結合をホスホロチオエート (PS) 結合に変える修飾(ホスホロチオエート化、S化)は、ヌクレアーゼ分解から核酸を保護するためにアンチセンスオリゴヌクレオチド合成に追加されます。全塩基の結合をPSバックボーンを含むよう修飾することも可能です。ただし、PS結合が追加されるたびに立体構造的な要因でTmは減少します。アンチセンス核酸に大規模なS化を行うと、非特異的なタンパク質への結合を促進します。この特性により、血清中での安定性が増し、細胞への取り込みが改善されますが、アンチセンス核酸の免疫受容体への非特異的結合により、炎症誘発性反応を引き起こす可能性もあります。
培養中の細胞にアンチセンス核酸やsiRNAを導入する方法は?
アンチセンス核酸を細胞に導入するには、リポソームの使用、リガンドへのオリゴの結合 (ペプチド、GalNAc、コレステロール、脂肪酸、アプタマー、抗体など)、エレクトロポレーション、直接送達など、いくつかの方法があります。

